Человеческий белок бета-амилоид (1-42), также известный как Aβ 1-42, является ключевым фактором в разгадке тайн болезни Альцгеймера.Этот пептид играет центральную роль в формировании амилоидных бляшек, загадочных скоплений, которые повреждают мозг пациентов с болезнью Альцгеймера.Обладая деструктивным действием, он нарушает нейронную связь, запускает воспаление и вызывает нейротоксичность, приводящую к когнитивным нарушениям и повреждению нейронов.Исследование механизмов его агрегации и токсичности не только жизненно важно;это захватывающее путешествие к решению загадки болезни Альцгеймера и разработке будущих методов лечения.



Aβ 1-42 представляет собой пептидный фрагмент из 42 аминокислот, который образуется в результате расщепления белка-предшественника амилоида (APP) β- и γ-секретазами.Aβ 1-42 является одним из основных компонентов амилоидных бляшек, которые накапливаются в головном мозге пациентов с болезнью Альцгеймера — нейродегенеративным заболеванием, характеризующимся когнитивными нарушениями и потерей памяти.Было показано, что Aβ 1-42 имеет различные функции и применения в биологических и биомедицинских исследованиях, таких как:
1.Нейротоксичность: Aβ 1-42 может образовывать растворимые олигомеры, которые способны связываться и нарушать функцию мембран, рецепторов и синапсов нейронов.Эти олигомеры также могут вызывать окислительный стресс, воспаление и апоптоз в нейронах, что приводит к потере синапсов и гибели нейронов.Олигомеры Aβ 1-42 считаются более нейротоксичными, чем другие формы Aβ, такие как Aβ 1-40, который является наиболее распространенной формой Aβ в головном мозге.Также считается, что олигомеры Aβ 1-42 способны распространяться от клетки к клетке, подобно прионам, и вызывать неправильное сворачивание и агрегацию других белков, таких как тау, который образует нейрофибриллярные клубки при болезни Альцгеймера.
Aβ 1-42 широко считается изоформой Aβ с самой высокой нейротоксичностью.Несколько экспериментальных исследований продемонстрировали нейротоксичность Aβ 1-42 с использованием различных методов и моделей.Например, Лесне и др.(Brain, 2013) исследовали образование и токсичность олигомеров Aβ, которые представляют собой растворимые агрегаты мономеров Aβ, и показали, что олигомеры Aβ 1-42 оказывают более сильное повреждающее воздействие на синапсы нейронов, что приводит к снижению когнитивных функций и гибели нейронов.Ламберт и др.(Труды Национальной академии наук, 1998) подчеркнули нейротоксичность олигомеров Aβ 1-42 и обнаружили, что они оказывают сильное токсическое воздействие на центральную нервную систему, возможно, за счет воздействия на синапсы и нейротрансмиттеры.Уолш и др.(Nature, 2002) продемонстрировали ингибирующее действие олигомеров Aβ 1-42 на долговременную потенциацию гиппокампа (LTP) in vivo, которая представляет собой клеточный механизм, лежащий в основе обучения и памяти.Это ингибирование было связано с ухудшением памяти и обучения, что подчеркивает влияние олигомеров Aβ 1-42 на синаптическую пластичность.Шанкар и др.(Nature Medicine, 2008) выделили димеры Aβ 1-42 непосредственно из мозга, страдающего болезнью Альцгеймера, и показали их влияние на синаптическую пластичность и память, предоставив эмпирические доказательства нейротоксичности олигомеров Aβ 1-42.
Кроме того, Су и др.(Molecular & Cellular Toxicology, 2019) провели транскриптомный и протеомный анализ нейротоксичности, индуцированной Aβ 1-42, в клетках нейробластомы SH-SY5Y.Они идентифицировали несколько генов и белков, на которые влияет Aβ 1-42, в путях, связанных с апоптотическим процессом, трансляцией белка, катаболическим процессом цАМФ и реакцией на стресс эндоплазматического ретикулума.Такеда и др.(Biological Trace Element Research, 2020) исследовали роль внеклеточного Zn2+ в нейротоксичности, индуцированной Aβ 1-42, при болезни Альцгеймера.Они показали, что индуцированная Aβ 1-42 внутриклеточная токсичность Zn2+ ускоряется с возрастом из-за возрастного увеличения внеклеточного Zn2+.Они предположили, что Aβ 1-42, постоянно секретируемый нейрональными окончаниями, вызывает возрастное снижение когнитивных функций и нейродегенерацию посредством внутриклеточной дисрегуляции Zn2+.Эти исследования показывают, что Aβ 1-42 является ключевым фактором, опосредующим нейротоксичность и прогрессирование заболевания при болезни Альцгеймера, влияя на различные молекулярные и клеточные процессы в головном мозге.
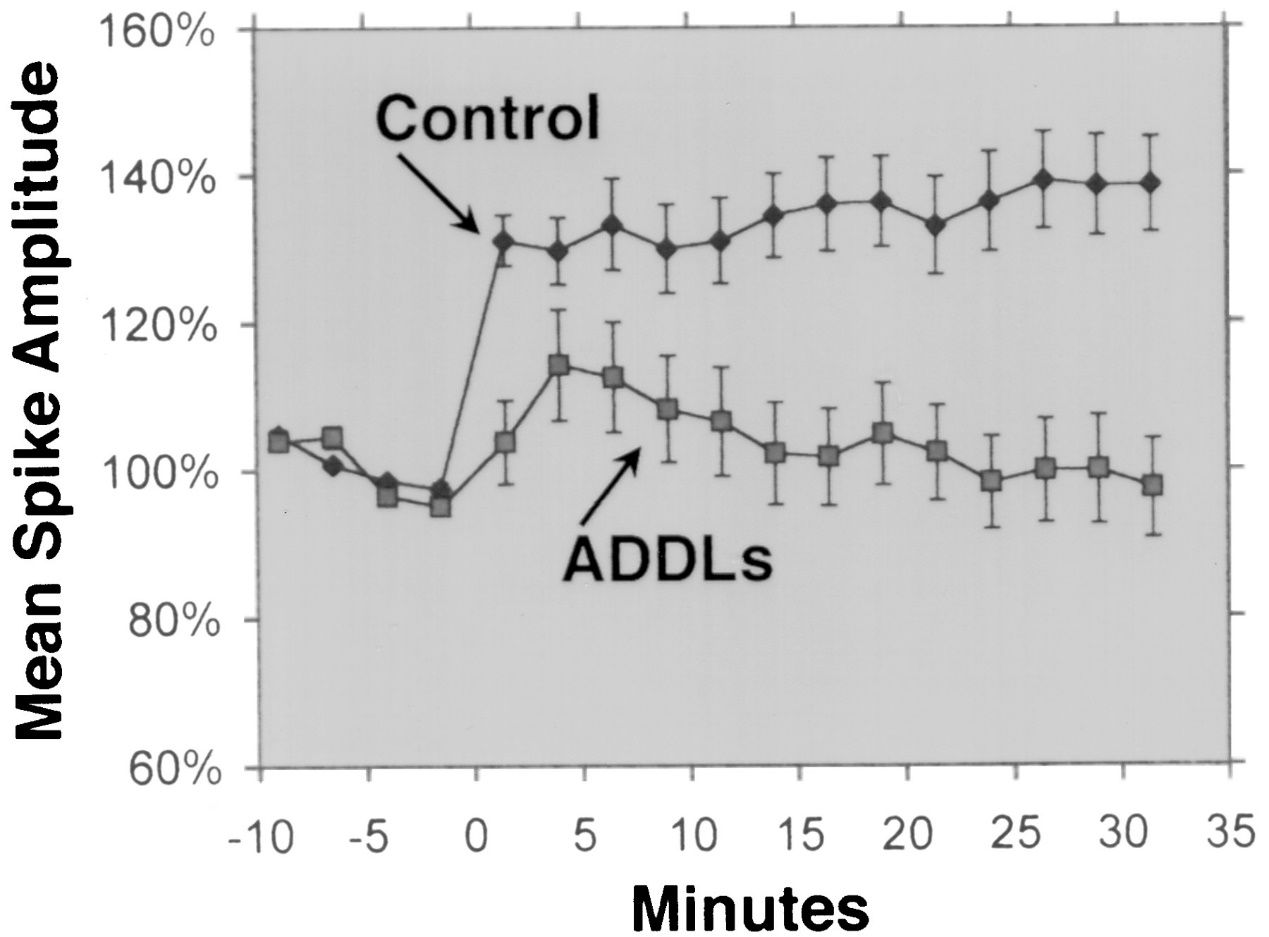
2. Антимикробная активность: Сообщалось, что Aβ 1-42 обладает антимикробной активностью против различных патогенов, таких как бактерии, грибы и вирусы.Aβ 1-42 может связываться и разрушать мембраны микробных клеток, что приводит к их лизису и гибели.Aβ 1-42 также может активировать врожденную иммунную систему и рекрутировать воспалительные клетки в место инфекции.Некоторые исследования показали, что накопление Aβ в мозге может быть защитной реакцией на хронические инфекции или травмы.Однако чрезмерное или нарушенное производство Aβ может также вызвать побочный ущерб клеткам и тканям хозяина.
Сообщалось, что Aβ 1-42 проявляет антимикробную активность против ряда патогенов, таких как бактерии, грибы и вирусы, такие как Staphylococcus aureus, Escherichia coli, Candida albicans и вирус простого герпеса типа 1, путем взаимодействия с их мембранами и вызывая их разрушение и лизис.Кумар и др.(Журнал болезни Альцгеймера, 2016) продемонстрировал этот эффект, показав, что Aβ 1-42 изменяет проницаемость мембран и морфологию микробных клеток, что приводит к их гибели.Помимо прямого противомикробного действия, Aβ 1-42 может также модулировать врожденный иммунный ответ и рекрутировать воспалительные клетки в место инфекции.Сосия и др.(PLoS One, 2010) выявили эту роль, сообщив, что Aβ 1-42 стимулирует выработку провоспалительных цитокинов и хемокинов, таких как интерлейкин-6 (IL-6), фактор некроза опухоли-альфа (TNF-α), моноцитарный хемоаттрактантный белок-1 (MCP-1) и макрофагальный воспалительный белок-1 альфа (MIP-1α) в микроглии и астроцитах, основных иммунных клетках головного мозга.
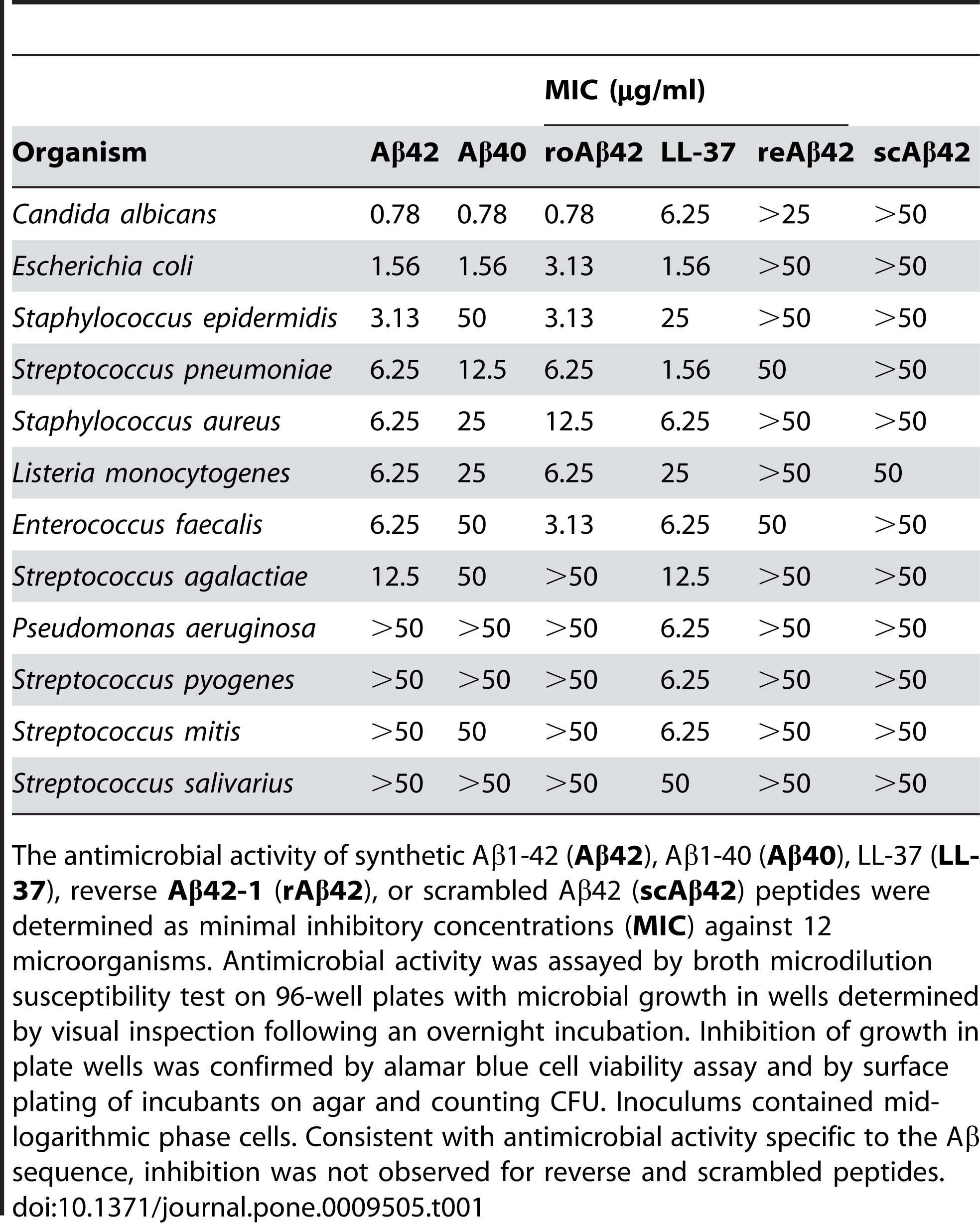
Рисунок 2. Пептиды Aβ обладают противомикробной активностью.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. Бета-амилоидный белок, связанный с болезнью Альцгеймера, представляет собой противомикробный пептид. PLoS One 2010, март 3;5(3):e9505.)
Хотя некоторые исследования показали, что накопление Aβ в головном мозге может быть защитной реакцией на хронические инфекции или травмы, поскольку Aβ может действовать как антимикробный пептид (АМФ) и устранять потенциальные патогены, сложное взаимодействие между Aβ и микробными элементами остается тема расследования.Хрупкий баланс подчеркивается исследованием Moir et al.(Журнал болезни Альцгеймера, 2018), который предполагает, что несбалансированное или чрезмерное производство Aβ может непреднамеренно нанести вред клеткам и тканям хозяина, что отражает сложную двойную природу роли Aβ в инфекции и нейродегенерации.Чрезмерное или нерегулируемое производство Aβ может привести к его агрегации и отложению в головном мозге с образованием токсичных олигомеров и фибрилл, которые нарушают функцию нейронов и вызывают нейровоспаление.Эти патологические процессы связаны со снижением когнитивных функций и потерей памяти при болезни Альцгеймера — нейродегенеративном заболевании, характеризующемся прогрессирующей деменцией.Следовательно, баланс между полезными и вредными эффектами Aβ имеет решающее значение для поддержания здоровья мозга и предотвращения нейродегенерации.
3. Экспорт железа: Было показано, что Aβ 1-42 участвует в регуляции гомеостаза железа в мозге.Железо является важным элементом для многих биологических процессов, но избыток железа также может вызвать окислительный стресс и нейродегенерацию.Aβ 1-42 может связываться с железом и облегчать его экспорт из нейронов через ферропортин, трансмембранный переносчик железа.Это может помочь предотвратить накопление и токсичность железа в мозге, поскольку избыток железа может вызвать окислительный стресс и нейродегенерацию.Дуче и др.(Cell, 2010) сообщили, что Aβ 1-42 связывается с ферропортином и увеличивает его экспрессию и активность в нейронах, что приводит к снижению внутриклеточных уровней железа.Они также показали, что Aβ 1-42 снижает экспрессию гепсидина, гормона, который ингибирует ферропортин, в астроцитах, еще больше увеличивая экспорт железа из нейронов.Однако связанный с железом Aβ также может стать более склонным к агрегации и отложению во внеклеточном пространстве, образуя амилоидные бляшки.Эйтон и др.(Журнал биологической химии, 2015) сообщил, что железо способствует образованию олигомеров и фибрилл Aβ in vitro и in vivo.Они также показали, что хелатирование железа снижает агрегацию и отложение Aβ у трансгенных мышей.Следовательно, баланс между полезными и вредными эффектами Aβ 1-42 на гомеостаз железа имеет решающее значение для поддержания здоровья мозга и предотвращения нейродегенерации.
Мы являемся производителем полипептидов в Китае и имеем многолетний опыт производства полипептидов.Компания Hangzhou Taijia Biotech Co., Ltd. является профессиональным производителем полипептидного сырья, который может предоставить десятки тысяч полипептидного сырья, а также может быть адаптирован в соответствии с потребностями.Качество полипептидной продукции превосходное, а чистота может достигать 98%, что признано пользователями во всем мире. Добро пожаловать к нам за консультацией.






